什么是Nanodisc?
纳米盘一词描述了一种小尺寸(直径: 7-50 nm)圆盘状结构物,可应用于蛋白质组学和生物医学等领域。纳米盘主要由两个组件构成: 1. 磷脂,可以是人造磷脂或细胞膜磷脂 2. 将磷脂绑定在一起的稳定带,可以是 MSP 蛋白或合成聚合物。
MSP(Membrane Scaffold Protein)纳米盘
MSP 纳米盘通过膜支架蛋白(Membrane Scaffold Protein)固定在一起。MSP可以是截短型载脂蛋白(apo)A-I,其包裹在一小块磷脂双分子层上,形成圆盘状颗粒或纳米盘(5)。MSP提供了面向脂质疏水尾的疏水面,以及外部的亲水面。这样设置使得纳米盘在水溶液中高度可溶。一旦组装成纳米盘,就可以在没有去污剂的情况下将膜蛋白保持在溶液中(5)。
尺寸:MSP 纳米盘的尺寸范围为 7 - 17 nm。尺寸由所采用的膜支架蛋白决定。表 2 描述了 由Cube Biotech 提供的膜支架蛋白及相关的纳米盘尺寸。相同 MSP 蛋白的MSP 纳米盘尺寸均一,直径仅相差 +/- 1 nm。非常适合进行使用冷冻电镜(Cryo-EM)的研究。
MSP种类 | 尺寸(直径 nm) | 参考 |
MSP1D1ΔH5 | 8.2 (+/- 0.6) | (5) |
MSP1D1 | 9.5 (+/- 1.1) | (5) |
MSP1E3D1 | 13 (+/-1) | (15) |
MSP2N2 | 17 (+/-1) | (21) |
MSP纳米盘的其他优点
与其他膜蛋白增溶和重组系统相比,MSP纳米盘具备许多优势,尤其在配体结合研究、构象动力学分析以及蛋白质相互作用研究等方面(6)。纳米盘可用于在类似于天然膜的人工环境中重组GPCR 或转运蛋白等膜蛋白质。
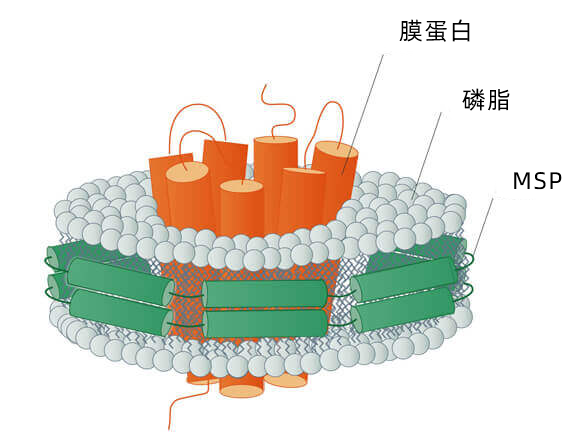
图 3:MSP 纳米盘示意图。
如何生成MSP纳米盘+蛋白-复合物
A:结合纳米盘与无细胞表达系统
从表达质粒开始,可在无细胞系统中生成膜蛋白。在整合了初生膜蛋白(8)的混合物中提供预组装纳米盘。不需要额外添加去污剂,这样可以最大限度地减少伪影的存在。作为一个可选项,可以将生物素酰化或同位素标记等修饰包含在内。B:去污剂增溶蛋白质的两步重组
从合适去污剂中的纯化膜蛋白开始,添加膜支架蛋白和磷脂。包含膜蛋白的纳米盘可自发形成,并通过亲和或排阻层析法纯化得到(6,7)。C:直接从膜增溶
从表达目标蛋白的膜开始,添加去污剂和膜支架蛋白(MSP)。膜磷脂、膜蛋白和 MSP 组装形成纳米圆盘复合物(5)。此处,获得了表征膜蛋白群的纳米盘复合物的混合物,可用于蛋白质组学研究。如果需要,可采用亲和色谱法纯化对单个膜蛋白-纳米盘复合物进行纯化处理。与方法 B 相比,接触去污剂的时间明显缩短了(从按天数缩短为按小时)。
图 4:两种用于将重组蛋白插入纳米盘的方法示意图。
A:将组装好的纳米盘添加到无细胞反应中。初生蛋白可自然插入。
B:将去污剂和MSP添加到表达目的蛋白的细胞质中。组成膜磷脂、蛋白质和 MSP的复合物。

稳定膜蛋白的纳米盘示意图
纳米盘的用途
纳米盘用于模拟细胞的天然磷脂双分子层,以此来寻找靶分子(通常为膜蛋白)。膜蛋白是细胞间通讯的关键物质,介导基本的生物过程,如信号转导、跨膜转运过程、化学信号传感及胞间相互作用的协调。
多种人体疾病都与膜蛋白有关,膜蛋白因而成为药物开发的重要靶标。然而,出乎意料的是,膜蛋白由高达约23%的基因进行编码,而其占已知蛋白质结构的比率却不足1%(1)。
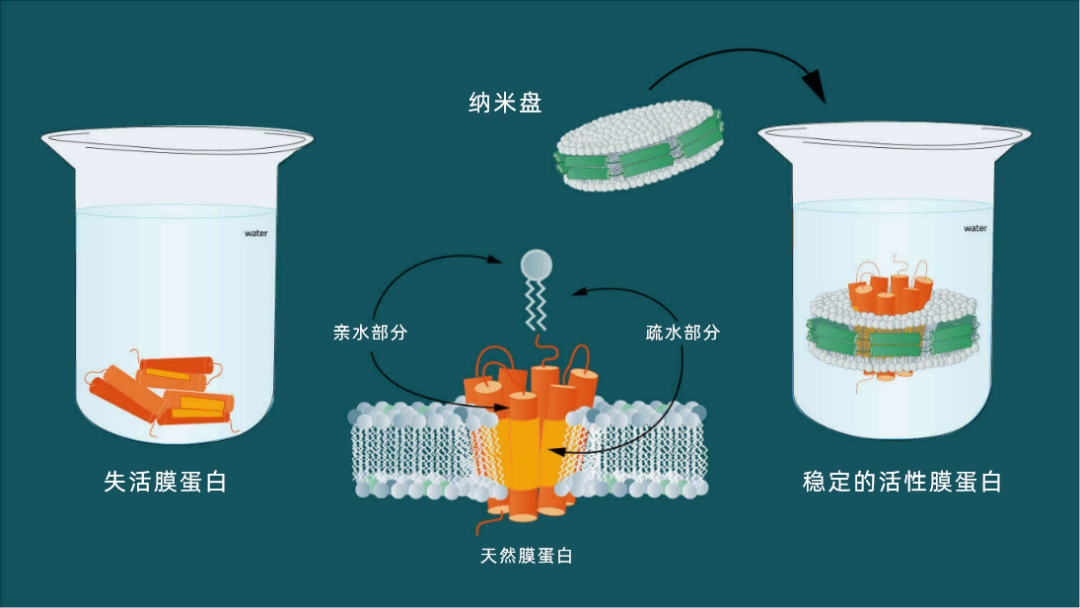
图 1:膜蛋白同时具有疏水性和亲水性。 纳米盘可以使膜蛋白溶于水溶液。
问题是,与可溶性蛋白质不同,膜蛋白嵌在脂质膜中,因此很难在天然环境中对其进行分析。磷脂双分子层疏水核心中的膜蛋白表层也具有疏水性,而与水性膜环境接触的表层区与普通可溶性蛋白的表层一样具有亲水性(2)。同一分子上广泛存在疏水和亲水表面,这是膜蛋白的特征。因此,在缺乏增溶剂的情况下,膜蛋白不溶于标准缓冲水溶液。例如,纳米盘需要溶解膜蛋白,以模拟磷脂双分子层的两亲环境,同时将膜蛋白的结构维持在生理相似的状态。
两种纳米盘类型
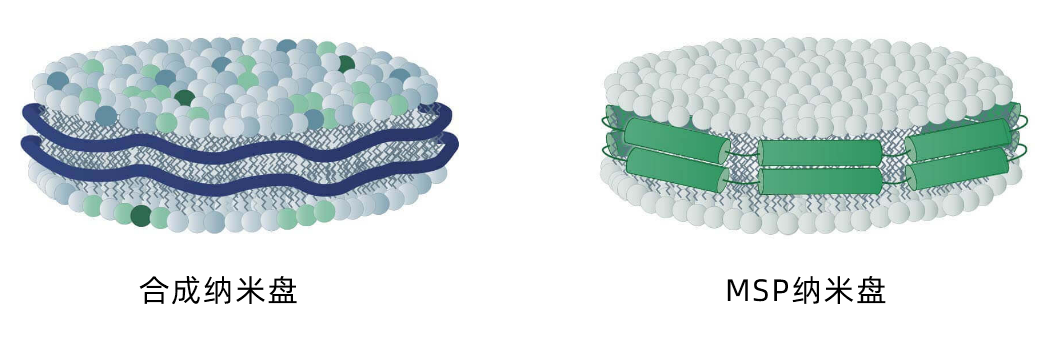
图 2:两种类型的纳米盘:合成纳米盘(蓝色稳定剂)和 MSP 纳米盘(绿色稳定剂)
如前所述,纳米盘的区别在于它们的磷脂成分,并且,最重要的是,在于它们的稳定剂类型。这种稳定剂的存在就是纳米盘被分成MSP(Membrane Scaffold Protein ) 纳米盘和合成纳米盘这两大类的原因。
两类纳米盘的名称分别源于其各自对应的稳定剂类型,而稳定剂用于维持纳米盘不分散,并快速形成纳米盘。稳定剂还决定了纳米盘脂质成分的组成要素。MSP 纳米盘总是包含人工脂质成分。这意味着,您能够完全控制它。相比之下,合成纳米盘由天然细胞磷脂制成。这里提供了两种纳米盘各自优势的直接对比结果。
表 1:MSP 纳米盘和合成纳米盘之间的简要对比
| 合成纳米盘 | 膜支架蛋白(MSP)纳米盘 |
带特性/稳定剂 | 合成聚合物(如 DIBMA、SMA) | MSP蛋白 |
脂质 | 天然细胞膜脂质 | 人造磷脂环境(如磷脂) |
实例 | 二异丁烯-马来酸(DIBMA)、苯乙烯-马来酸(SMA)、amphipol | 预组装纳米盘 |
磷脂的选择——维持适当蛋白质活性的关键
如前所述,MSP 纳米盘的磷脂成分是人造的。这意味着,必须事先确定好构成目的膜蛋白所需人工膜环境的磷脂。但存在多种磷脂可供选择,应该选择哪一种呢?
对于这个问题,请参阅我们最常用于 MSP 纳米盘的磷脂列表。
二肉豆蔻酰磷脂酰胆碱(DMPC)
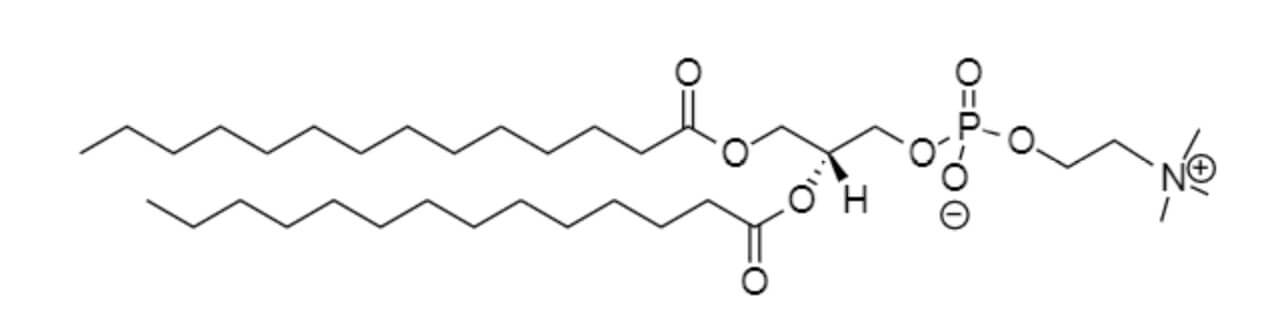
棕榈酰-油酰-磷脂酰胆碱(POPC)
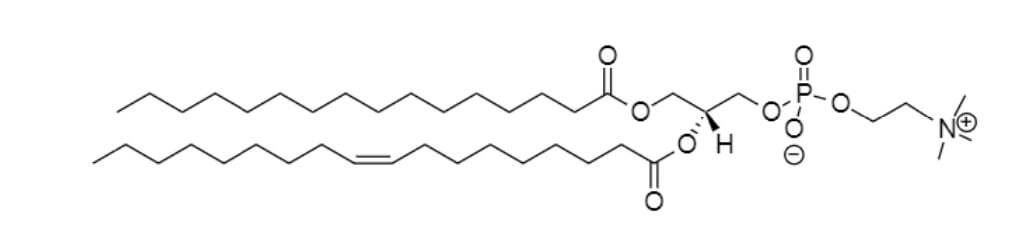
磷脂酰甘油(DMPG)
这些选项以及其他众多磷脂已成功实现单独或组合应用(8,25)。脂质的选择已经被证明对蛋白质活性是至关重要的(8),例如在脂质促进蛋白质低聚反应的情况下(25)。使用组装好的纳米盘进行无细胞表达是围绕各种脂质和脂质混合物对蛋白质的影响对其进行筛选的快捷简便方法。
MSP纳米盘在科学中的应用实例
MSP纳米盘最初是由Sligar及其同事一起发表的(3,4)。MSP纳米盘为稳定膜蛋白提供了完美的环境,使得通过NMR 和 SPR(9,10)等方法研究配体、激动剂或拮抗剂的结合成为可能。纳米盘被证实可以提高 在冷冻电镜中跨膜蛋白区的分辨率(22,26)。膜支架蛋白可采用组氨酸标记,以促进蛋白质纳米盘复合物的纯化、检测和固相处理。其他纳米盘应用的实例包括共振拉曼(11)、MALDI(13)、非共价质谱法(25)、蛋白激活研究(14)、时间分辨荧光光谱(15)和蛋白质结晶(24)。重组成纳米盘的抗原已被用于提高小鼠的免疫原应答,显示出其作为疫苗的潜力 (16)。此外,“大肠杆菌”的整个膜蛋白质组被重组为纳米盘,从而创建出水溶性膜蛋白库 (15)。在纳米盘中重组的蛋白质可以转移到双层膜微胞中以提高 NMR 分辨率(23)。在纳米盘的协助下,甚至实现了对可溶性蛋白质以及与脂质相互作用的蛋白质的分析 (20)。表 3 列出了纳米盘应用的实例。
Application | Protein studied | Origin | Reference |
Agonist/antagonist bindingand radiolabel exchange in G proteins | beta andrenergic receptor 2 | human | (7) |
Radioligand binding / scintillation proximity assay | LeuT transporter | bacteria | (19) |
Surface plasmon resonance (SPR) | CD4 mutant | human | (10) |
Resonance Raman spectroscopy | cytochrome P450 | mammalian | (11) |
Time-resolved fluorescence spectroscopy | light harvesting complex II (LHCII) | spinach | (15) |
Matrix assisted laser desorption/ionization mass spectrometry (MALDI-MS) | various | various | (13,17) |
Non-covalent mass spectrometry (LILBID-ESI-MS) | KcsA LspA, EmrE, Hv1, proteorhodopsin, MraY | human bacteria | (25) |
Electron microscopy (EM) | light harvesting complex II (LHCII) | spinach | (15) |
Cryo electron microscopy (EM) | cySecYEG complex TcdA1 toxin complex TRPV1 tetramer | bacteria human | (12,22,26) |
Mouse vaccination | hemagglutinin (HA) | influenza virus | (16) |
Nuclear magnetic resonance (NMR) | OmpX CD4 mutant | human bacteria | (5,9) |
Solid state NMR | green proteorhodopsin | marine bacteria | (18) |
NMR analysis of lipid-interacting, soluble proteins | phospho-inositol binding proteins | human | (20) |
Transfer into bicelles for NMR | lipoprotein signal peptidase II (LspA) | human | (23) |
In meso phase crystallization | bacteriorhodopsin (BR) | archae-bacteria | (24) |
Protein phosphorylation / activation studies | epidermal growth factor receptor (EGFR) | human | (14) |












 首页
首页




