PureCube DIBMA–无去污剂法增溶膜蛋白
去垢剂(如SDS,n-辛基-β-d-葡萄糖苷(OG),n-十二烷-β-d-麦芽糖苷(DDM))被广泛用于膜蛋白的提取,但众所周知,不同去垢剂有着不同的缺点,例如短链非离子型去垢剂会影响膜蛋白的功能特性。几乎可以确定的是如果将天然的磷脂双分子层从膜蛋白中移除,膜蛋白的功能会受到影响。目前可通过MSP-nanodiscs(膜结构蛋白-纳米磷脂盘)(图一)或者无去污剂聚合物体系(图二)(苯乙烯-马来酸共聚物(SMAs)、二异丁烯-马来酸(DIBMA))来模拟天然磷脂双分子层。使用后者可直接从细胞中提取膜蛋白,而无需任何去污剂增溶的中间步骤,因为这些合成聚合物能利用本身带有的苯乙烯或马来酸基团来增溶膜蛋白。
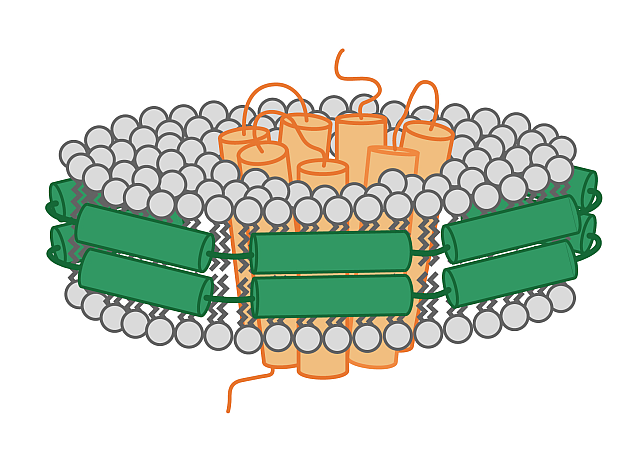
图一.带有目的蛋白的纳米磷脂盘和膜结构蛋白(MSPs,绿色)。
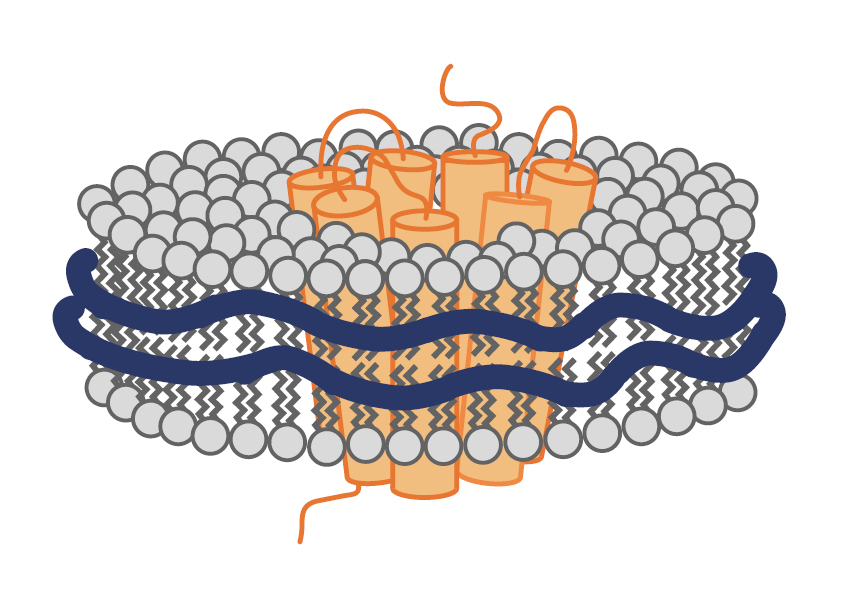
图二.带有目的蛋白的合成聚合物例如SMA或DIBMA。
为何PureCube DIBMA比SMAs对蛋白增溶更具优势呢?
SMAs相较于许多去垢剂来说有着巨大的优势,并成功地被广泛应用。但SMAs有一个缺点,即在溶解时对紫外线有较高吸光值,吸收波长为280nm。蛋白质因含有芳香族氨基酸(色氨酸和苯丙氨酸)而对紫外线在280nm有广泛吸收,而SMAs也自带一个芳香环,因此在使用SMAs对膜蛋白增溶、稳定和纯化的过程中无法测定蛋白浓度。而选用德国库柏生物的PureCube DIBMA能够在不使用任何去污剂的情况下对膜蛋白进行增溶、稳定和纯化并且完全不影响蛋白浓度的测定。
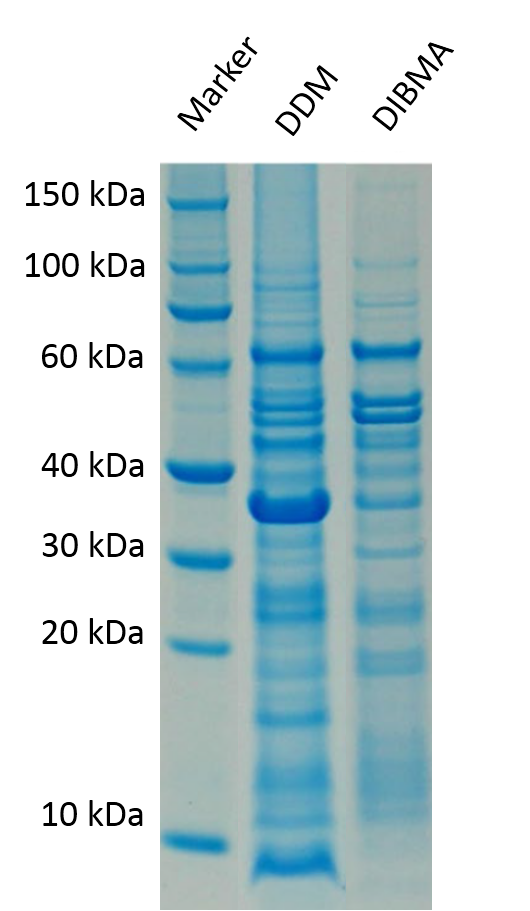
图3:从大肠杆菌中提取到的膜蛋白的SDS-PAGE图。
使用了10 mM (0.5 % (w/v)) DDM和3 mM (2.5 % (w/v)) DIBMA。

图4:二异丁烯-马来酸(DIBMA)的化学结构式。
为何选择德国库柏生物公司的PureCube DIBMA?
我们提供高度纯化且冻干的产品。除此之外,由于大多数蛋白增溶时最合适的pH值为7.5,PureCube DIBMA可用两种缓冲液(HEPES或TRIS)冻干,以确保pH稳定在7.5。如果你需要用其他不同的缓冲液冻干PureCube DIBMA,请与我们联系。根据样品和需求的不同,可选择中等长度10,000或12,000g/mol的DIBMA。
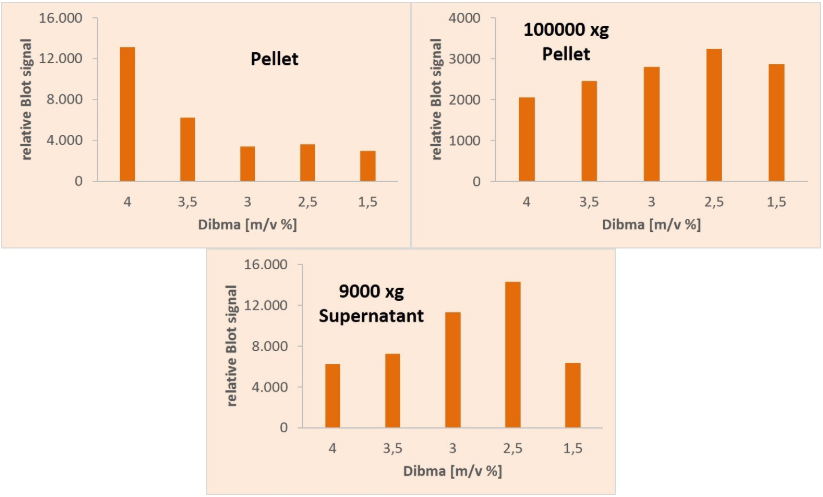
图5:DIBMA溶解来自沉淀的蛋白质,上清液9000 xg和沉淀100000 xg。
使用不同浓度的DIBMA来确定完美的溶解条件。
特征:
用法 | 蛋白质溶解 |
分子质量 | ~12,000g / mol或10,000g / mol |
dn/dc(比折光指数增量) | 1.35 M-1 |
溶解度 | > 10%,溶于水 |
在280nm处的吸光度 | <0.3(1%溶液) |
Mg 2+耐受性 | 25 mM |
Ca 2+耐受性 | 20 mM |
参考文献:
1. Seddon, Annela M., Paul Curnow, and Paula J. Booth. "Membrane proteins, lipids and detergents: not just a soap opera." Biochimica et Biophysica Acta (BBA)-Biomembranes 1666.1-2 (2004): 105-117.
2. Knowles, Timothy J., et al. "Membrane proteins solubilized intact in lipid containing nanoparticles bounded by styrene maleic acid copolymer." Journal of the American Chemical Society 131.22 (2009): 7484-7485.
3. Oluwole, Abraham Olusegun, et al. "Solubilization of Membrane Proteins into Functional Lipid‐Bilayer Nanodiscs Using a Diisobutylene/Maleic Acid Copolymer." Angewandte Chemie International Edition 56.7 (2017): 1919-1924.
4. Oluwole, Abraham Olusegun, et al. "Formation of lipid-bilayer nanodiscs by diisobutylene/maleic acid (DIBMA) copolymer." 33.50 (2017): 14378-14388.
5. Long AR, O’Brien CC, Malhotra K, Schwall CT, Albert AD, Watts A, Alder NN (2013) A detergent-free strategy for the reconstitution of active enzyme complexes from native biological membranes into nanoscale discs. BMC Biotechnol 13:41.
6. Dörr, Jonas M., et al. "The styrene–maleic acid copolymer: a versatile tool in membrane research." European Biophysics Journal 45.1 (2016): 3-21.
7. Grethen, Anne, et al. "Thermodynamics of nanodisc formation mediated by styrene/maleic acid (2: 1) copolymer." Scientific reports 7.1 (2017): 11517.
8. Oluwole, Abraham Olusegun, et al. „Solubilization of Membrane Proteins into Functional Lipid‐Bilayer Nanodiscs Using a Diisobutylene/Maleic Acid Copolymer.“ Angewandte Chemie International Edition 56.7 (2017): 1919-1924.
9. Lee, Sarah C., et al. „A method for detergent-free isolation of membrane proteins in their local lipid environment.“ Nature protocols 11.7 (2016): 1149.
10. Wessel, D. M., and U. I. Flügge. „A method for the quantitative recovery of protein in dilute solution in the presence of detergents and lipids.“ Analytical biochemistry 138.1 (1984): 141-143.












 首页
首页 Facebook
Facebook WeChat
WeChat Twiitter
Twiitter
