如何获得纯净且活性的膜蛋白

Rho1D4 tag / 1D4 tag
Rho1D4,也叫“1D4”,是一种亲和标记物,包含了九种氨基酸(T-E-T-S-Q-V-A-P-A)。该标记物优先与目标蛋白的C端结合。琼脂糖和磁珠与相对应的Rho1D4-抗体能够纯化标记了Rho1D4标签的蛋白。Rho1D4蛋白纯化实验不仅拥有基于其它抗体为基础的蛋白纯化极高的专一特异性,并且蛋白的产量也很高。关于Rho1D4的更多信息,我们撰写了一本指南为您提供所有必需信息。
产品技术参数
用途 | 特异性结合和纯化Rho1D4标记的蛋白 |
特异性 | 具有与Rho1D4标记的蛋白亲和力 |
稳定性 | 高耐受去污剂 |
微球配基 | Rho1D4抗体 |
蛋白产量 | 3-4 mg/ ml琼脂糖或磁珠 |
标记序列 | TETSQVAPA |
为什么选择库柏生物(Cube Biotech)的Rho1D4 Tag蛋白纯化产品?
选择Cube Biotech公司的理由有很多。以下为其中几点:
标记的大小:902.9 Da, 9个氨基酸(TETSQVAPA)
每毫升树脂蛋白产量:3-4 mg/ml
相互作用的特异性:KD:20 nM
洗脱条件:Rho1D4肽、低pH值或标记裂解
Cube Biotech的Rho1D4亲和蛋白纯化的产品概览:
Rho1D4 琼脂糖 (40 µm) | Rho1D4 琼脂糖 (40 µm) | Rho1D4 磁珠(30 µm) |
Rho1D4琼脂糖(90µm大粒径) | Rho1D4琼脂糖 (40 µm) 通用型预装柱 | Rho1D4磁珠 (大粒径) |
Rho1D4 Starter试剂盒——面向所有首次想要尝试Rho1D4标签的用户。 |
|
|
Starter试剂盒 1 (1 mL 琼脂糖 + 5 mg 肽) | Starter试剂盒3 (1 x 1 mL 预装柱 + 5 mg 肽) | Starter试剂盒 2 (1 mL 磁珠+ 5 mg 肽) |
| Starter试剂盒 4 (1 x 1ml 小型预装柱 + 5mg 肽) |
|
Rho1D4蛋白纯化支持产品:
Rho1D4 肽 (用于蛋白竞争洗脱) | Rho1D4 带 GFP标签 (用于对照) | Rho1D4 抗体 [鼠源] (用于western blot) |
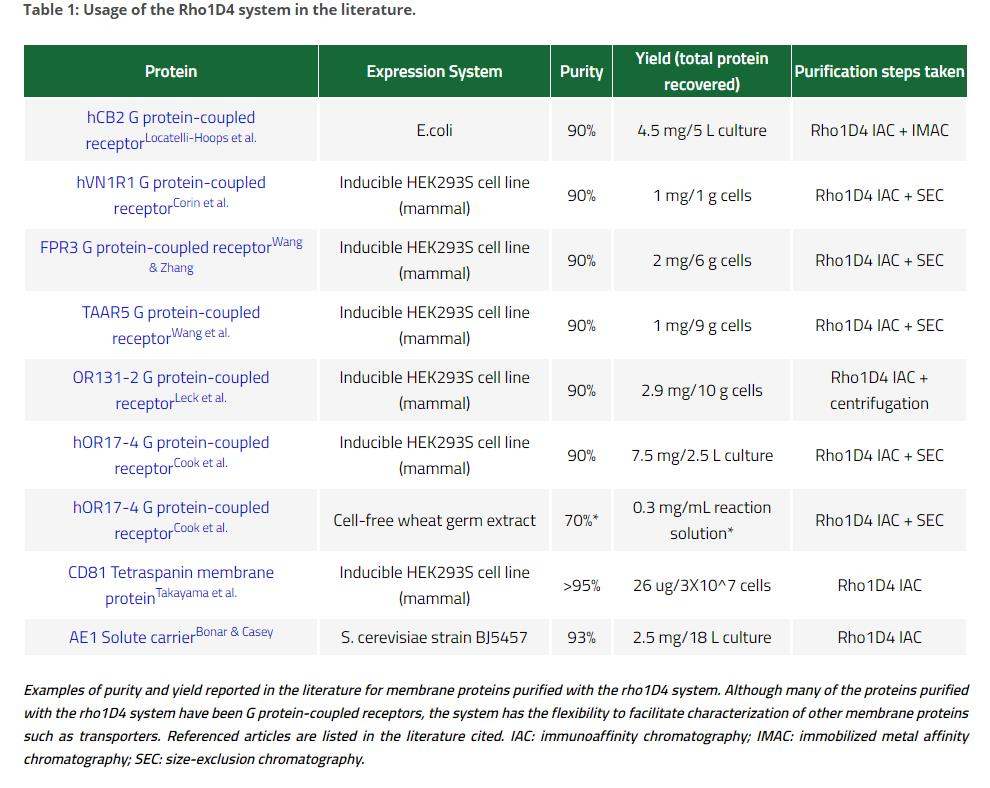
Cube Biotech的Rho1D4产品在以下论文刊物中出现:
Rho1D4标签的特点:
我们收集了关于Rho1D4标签及其蛋白质纯化能力的最重要数据。
高特异性和高产量的蛋白纯化
PureCube系列琼脂糖依据严格的质量标准进行生产,每一批次均经过质量检验,以确保加载的基质具有高蛋白载量。由于抗原-抗体表位相互作用的特异性,针对目标蛋白优化的纯化操作流程可以产生高产量的洗脱组份。图1 展现了趋化因子受体4(CXCR4)的纯化过程。标记的目标蛋白在大肠杆菌中表达,用Fos-Choline®-14进行溶解,并在装有PureCube Rho1D4琼脂糖的预装柱上进行纯化。以Rho1D4肽作为洗脱剂,4个洗脱组分的蛋白质总复原浓度为0.8、1.0、0.85和0.6mg/mL。通过western blot显示CXCR4约在 65 kDa 和 35 kDa之间。这些条带代表 39.7 kDa 膜蛋白的二聚体和单体。单体和二聚体的分离,就像去除洗脱肽的方式一样,可以通过排阻层析的方式完成。
纯净且活性的膜蛋白
膜蛋白纯化结果无法用更常用的琼脂糖(如 Ni-NTA)进行保存。因此,Rho1D4是您获得纯净且活性的膜蛋白可以选择的方式。
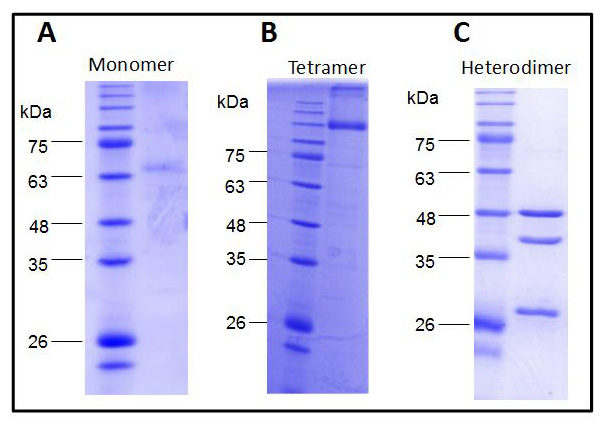
图1.使用 Rho1D4 标记膜蛋白成功纯化的考马斯亮蓝色染色。A:~65kDa的蛋白质单体。B:~135kDA的四聚体。C: 异二聚体,均可见亚基,和一条较小的不可识别条带。怀疑为降解产物。
References
1.Molday, L. L. & Molday, R. S. 1D4: a versatile epitope tag for the purification and characterization of expressed membrane and soluble proteins. Methods Mol Biol 1177, 1–15 (2014).
2. Hodges, R., Heaton, R., Parker, J. M. R., Molday, L. & Molday, R. Antigen-antibody interaction. Synthetic peptides define linear antigenic determinants recognized by monoclonal antibodies directed to the cytoplasmic carboxyl terminus of rhodopsin. The Journal of biological chemistry 263, 11768–75 (1988).
3. Locatelli-Hoops, S. C., Gorshkova, I., Gawrisch, K. & Yeliseev, A. A. Expression, surface immobilization, and characterization of functional recombinant cannabinoid receptor CB2. Biochim Biophys Acta 1834, 2045–2056 (2013).
4. Takayama, H., Chelikani, P., Reeves, P., Zhang, S. & Khorana, H. High-Level Expression, Single-Step Immunoaffinity Purification and Characterization of Human Tetraspanin Membrane Protein CD81. PloS one 3, e2314 (2008).
5. Cook, B. L. et al. Large-scale production and study of a synthetic G protein-coupled receptor: Human olfactory receptor 17-4. Proc Natl Acad Sci USA 106, 11925 (2009).
6. MacKenzie, D., Arendt, A., Hargrave, P., McDowell, J. & Molday, R. Localization of binding sites for carboxyl terminal specific anti-rhodopsin monoclonal antibodies using synthetic peptides. Biochemistry 23, 6544–6549 (1984).
7. Wang, X. & Zhang, S. Production of a Bioengineered G-Protein Coupled Receptor of Human Formyl Peptide Receptor 3. PLOS ONE 6, e23076 (2011).
8. Bonar, P. & Casey, J. Purification of functional human Cl-/HCO3 - exchanger, AE1, over-expressed in Saccharomyces cerevisiae. Protein expression and purification 74, 106–15 (2010).
9. Corin, K. et al. Structure and function analyses of the purified GPCR human vomeronasal type 1 receptor 1. Scientific Reports 1, 172 (2011).
10. Cook, B., Tourle, K., Chung, H. & Zhang, S. Study of a Synthetic Human Olfactory Receptor 17-4: Expression and Purification from an Inducible Mammalian Cell Line. PloS one 3, e2920 (2008).
11. Leck, K., Zhang, S. & Hauser, C. Study of Bioengineered Zebra Fish Olfactory Receptor 131-2: Receptor Purification and Secondary Structure Analysis. PloS one 5, e15027 (2010).
12. Wang, X., Corin, K., Rich, C. & Zhang, S. Study of two G-protein coupled receptor variants of human trace amine-associated receptor 5. Scientific Reports 1, 102 (2011).












 首页
首页 Facebook
Facebook WeChat
WeChat Twiitter
Twiitter
