膜蛋白在细胞与外界进行物质、信息、能量交换中具有重要的作用和意义,因此膜蛋白成为了当前研究热点之一。但是由于膜蛋白存在疏水部分,因此在体外容易聚合,所以需要找到一种合适的方法让膜蛋白能够稳定地存在于细胞外的环境。传统的膜蛋白提取方法是利用去污剂来提取,但是经过去污剂提取后的膜蛋白其构象和生物学活性都较易因为各种问题被破坏,作为“镶嵌”在细胞膜磷脂双分子层中的蛋白,一旦脱离了其稳定的天然膜环境,便会影响甚至失去其生理功能,即使膜蛋白被成功地提取出来,也达不到很好的研究结果。
早在上个世纪90年代,来自University of Illinois的生化学家Stephen Sligar教授就提出了一种命名为“Nanodisc”的磷脂层结构,能够有效地解决膜蛋白提取后在体外环境中稳定存在的问题,从而确保膜蛋白能够像在天然的细胞膜中维持其构象和生物学功能。Nanodiscs这种全新的膜蛋白提取工具突破了原有提取方法的瓶颈,能够高效而温和地辅助于膜蛋白的提取和保持其构象,这种全新的膜蛋白提取辅助工具可以解决以上传统提取方法容易出现的问题。
Nanodiscs已经应用于许多著名的科研院校、制药企业,推动了膜蛋白相关领域的研究进展。本文将对这种技术做一个详细的解读与应用说明。
1)什么是Nanodiscs?
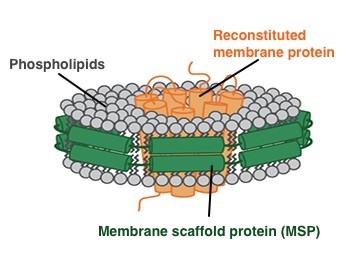
Nanodiscs是由膜支架蛋白(membrane scaffold proteins, MSPs)和磷脂分子构成的磷脂双分子层类膜结构。通过这种特殊的结构,膜蛋白可以整合到Nanodiscs中,保持其生物学活性,为膜蛋白研究提供了有力的技术支持,打通了膜蛋白研究中的瓶颈之一。
膜支架蛋白(MSPs)是载脂蛋白(apo) A-I的缩减版,它们包绕着脂质双分子层从而形成圆盘状的结构,即纳米盘3。其包含一个朝向内部脂层的疏水面和朝外的亲水面。这一结构使得Nanodiscs在水溶液中具有很高的溶解度,同时在没有去污剂的情况下也可以使膜蛋白溶解。
常用的磷脂为二肉豆蔻酰磷脂酰胆碱(DMPC)或棕榈酰油酰磷脂酰胆碱(POPC),它们可以与(apo) A-I组装成纳米盘,并与溶解膜蛋白的去污剂胆酸钠一起结合使用。
图1:膜蛋白组装到Nanodiscs的原理图。绿色:膜支架蛋白(MSPs);灰色:磷脂;橙色:膜蛋白。
根据所使用的MSPs的不同,形成的Nanodiscs的直径会有所差异,这些纳米级双层微粒的直径约为7-13纳米。应用广泛的MSPs包括MSP1D1、MSP1D1-dH5和MSP1E3D1。具体尺寸见表1。
表1 不同类型的MSPs的尺寸
MSP类型 | 尺寸(nm) |
MSP1D1 | 9.5(+/-1.1) |
MSP1D1-dH5 | 8.2(+/-0.6) |
MSP1E3D1 | 13(+/-1) |
2)为什么选择Nanodiscs
在膜蛋白研究方面,尤其是配体结合研究、构象动力学分析以及蛋白相互作用的研究,Nanodiscs体系与其他体系相比有诸多优势4。Nanodiscs可以使膜蛋白,如GPCRs或转运蛋白等,在人造环境里和纳米盘重新组装起来,形成类似天然的细胞膜结构。这种组装到Nanodisc中的可溶性蛋白可以在没有去污剂的情况下用常规的层析方法来进行纯化。(这个部分我们需要多查些资料看下)Nanodisc与膜蛋白的组装结构使得膜蛋白能够在体外研究膜蛋白在生理上细胞内和细胞外的两面,因此也使得进一步研究拮抗剂,激动剂,G蛋白以及其他相互作用的配体等不再受限。
3)Nanodiscs优势:
Nanodiscs能够为提取出来的膜蛋白提供一个稳定环境使它们继续工作,就好像还没有离开原来细胞膜一样。 细胞膜蛋白之所以研究难度大是在于膜蛋白从细胞膜上提取出来以后就无法行使其正常功能,使得研究这些受体分子相当困难。为了解决这项难题,Stephen Sligar 等科学家研发出一种脂质纳米圆盘 (lipid-based Nanodiscs)可以替代细胞膜上磷脂双层膜 (phospholipid bilayer),让被纯化出来的细胞膜蛋白如同一般细胞膜蛋白一样稳定地行使其正常功能。
Nanodiscs和天然的细胞膜的组成结构一样,是由两层磷脂层组成的,每个磷脂分子都有活跃并亲水的头部基团和疏水尾部。Nanodiscs 的结构就像一般细胞膜一样,由两层背对背的磷脂 (phospholipid)所组成,为了使纳米圆盘表面能保持这个扁平的形状,研究人员给这个Nanodiscs 外面加上一圈蛋白质(MSPs)。
Nanodiscs应用前景非常广泛,这个技术将有助于解开一大堆未知的膜蛋白的生化行为模式,也将有可能帮助得到膜蛋白的结晶,从而应用X 射线晶体衍射学获得在原子水平上的结构图。
4)将膜蛋白组装到Nanodiscs中的两种方法:
方法1:组装溶解在去污剂中的膜蛋白
在适合去污剂存在下,将膜蛋白溶解并纯化,然后再添加MSPs和磷脂。含有膜蛋白的Nanodiscs能够自发地组装,在去除掉表面活性剂后可以通过凝胶过滤(排阻层析)等方式来纯化。
方法2:Nanodiscs与无细胞表达体系相结合
另一个方法是,膜蛋白在无细胞表达体系中被表达,通过加入已经和膜蛋白结合预先组装的Nanodiscs,膜蛋白能通过无细胞表达系统表达出来。采用这种方法,就无需再添加去污剂,在很大程度上降低了人为添加试剂对结果的影响。
虽然通过无细胞表达体系会将蛋白的产量限制在微克级别,但这种方式却为蛋白修饰,如生物素酰化或同位素标记等研究手段提供了更多发展方向的可能性。
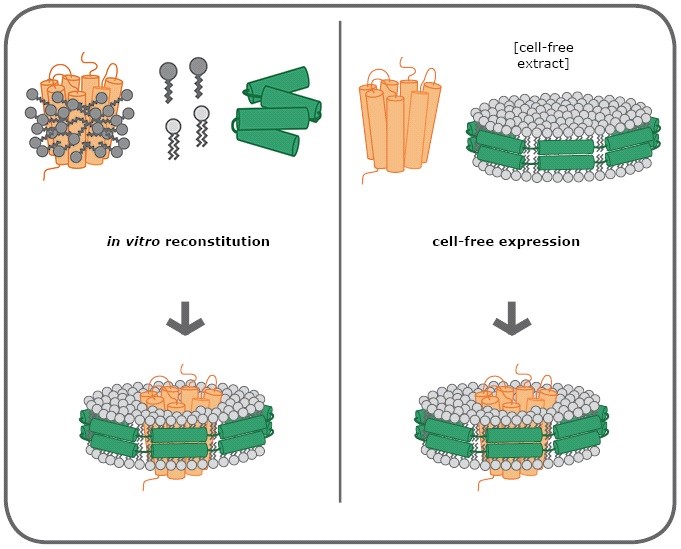
图2:膜蛋白与Nanodisc的两种组装机制
左图:膜蛋白(橙色)溶解在去污剂(深灰色)中并与冻干的MSP(绿色)和磷脂(浅灰)混合。然后去除去污剂,形成蛋白-Nanodisc复合物。
右图:预组装了MSP与磷脂的Nanodiscs加入到无细胞反应液(cell-free expression systems)中,新生的膜蛋白能够自发地组装到Nanodiscs中。
5)Nanodiscs的应用
Nanodiscs为膜蛋白在体外提供了非常稳定的环境,并且可以在这个环境下研究配体的结合,或用NMR和SPR研究拮抗剂与激动剂。MSPs可以与组氨酸标签结合来促进纯化、检测和固定化。
Nanodiscs其他方面的应用还包括共振拉曼(resonance Raman),低温电子显微学(Cryo-EM),MALDI ,蛋白活性研究和时间分辨荧光光谱。将抗原组装到Nanodiscs中已经被用来提高小鼠的免疫反应,说明其具备用于制备疫苗和生产抗体的极大潜能。最近,大肠杆菌全细胞膜蛋白组被组装到了Nanodiscs中,为以后的研究构建了一个可溶解的膜蛋白信息库。表2中例举了很多Nanodiscs的应用。
表2 Nanodiscs应用举例
应用 | 蛋白 | 来源 |
激动剂、拮抗剂、G蛋白放射性标记交换研究 | β-肾上腺素受体 2 | 人 |
NMR | 外膜蛋白X | 细菌 |
CD4突变体 | 人 |
SPR | CD4突变体 | 人 |
共振拉曼光谱 | 细胞色素 P450 | 哺乳动物 |
冷冻电子显微镜 | SecYEG复合体 | E.coli |
MALDI-MS | 各种蛋白 | 各种来源 |
蛋白磷酸化/激活研究 | 表皮生长因子受体 | 人 |
EM | 捕光色素复合体Ⅱ | 菠菜 |
时间分辨荧光光谱 | 捕光色素复合体Ⅱ | 菠菜 |
小鼠免疫 | 血凝素A | 流感病毒 |
固态NMR | 绿色视紫质膜蛋白 | 海洋细菌 |
放射配体结合/闪烁近亲测定法 | LeuT转运蛋白 | 原核生物 |
NMR分析脂质相互作用 | 磷脂酰肌醇结合蛋白 | 人 |
(来源:Sligar Lab)
在过去几年里,业内已经发表了多篇关于Nanodiscs的应用文献,例如:Nanodisc系列产品MSP1D1-His和MSP1D1dH5-His的应用已刊登在《美国化学会-应用材料与界面》(ACS Applied Materials & Interfaces),Cube Biotech首席科学家Dr. Barbara Maertens、法兰克福大学生物物理化学研究所 Dr. Frank Bernhard和Dr. Erik Henrich在Springer旗下的BIOspektrum期刊联合发表文章并提出Cube Biotech 研制的Nanodisc(纳米磷脂盘)是用于高效提取膜蛋白以及研究膜蛋白结构/功能的新工具。目前,许多研究人员正在利用这项新技术研究出更多与之相关的技术与应用。
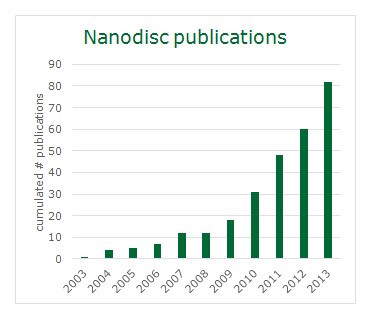
图3:有关Nanodiscs的文献发表情况。从2003—2013年,利用Nanodiscs进行膜蛋白研究的相关报道在不断增加。(来源:PubMed)
6)获得Nanodiscs
Cube Biotech提供四种尺寸的Nanodiscs,其由四种MSPs(MSP1D1/MSP1D1-dH5/MSP1E3D1/ MSP2N2)来实现、Nanodiscs试剂盒(包含MSP、磷脂和胆酸钠)和预组装的Nanodiscs。
产品列表:
Cube Biotech
Nanodisc | Nanodisc 试剂盒 |
MSPs尺寸 | 规格 | MSPs尺寸 | 匹配磷脂 |
MSP1D1 | 2mg | MSP1D1 | DMPC |
10mg | POPC |
MSP1D1-dH5 | 2mg | MSP1D1-dH5 | DMPC |
10mg | POPC |
MSP1E3D1 | 2mg | MSP1E3D1 | DMPC |
10mg | POPC |
参考文献:1.Bayburt, T.H. et al. Reconstitution and imaging of a membrane protein in a nanometer-size phospholipid bilayer. J. Struct. Biol. (1998), 123(1):37-44
2.Civjan, N.R. et al. Direct solubilization of heterologously expressed membrane proteins by incorporation into nanoscale lipid bilayers. BioTechniques (2003) 35:556-563
3.Hagn, F. et al. Optimized phospholipid bilayer Nanodiscs facilitate high-resolution structure determination of membrane proteins. J.Am.Chem. Soc. (2013), 135:1919-1925
4.Serebryany et al. Artificial membrane-like environments for in vitro studies of purified G-protein coupled receptors. Biochim. Biophys. Acta (2012), 181:225-233
5.Leitz, J. et al. Functional reconstitution of beta2-adrenergic receptors utilizing self-assembling Nanodisc technology. BioTechniques (2006), 40:601-612
6.Proverbio D., et al. Functional properties of cell-free expressed human endothelin A and endothelin B receptors in artifical membrane environments. Biochim.Biophys. Acta (2013), 1828(9):2182-92
7.Glueck, J.M. et al. Integral membrane proteins in Nanodiscs can be studied by solution NMR spectroscopy. J.Am.Chem.Soc. (2009), 131(34):12060-1
8.Glueck, J.M. et al. Nanodiscs allow the use of integral membrane proteins as analytes in surface plasmon resonance studies. Anal. Biochem. (2011), 408(1):46-52
9.Mak, P.J. et al. Defining CYP3A4 structural responses to substrate binding. Raman spectroscopic studies of a Nanodisc-incorporated mammalian cytochrome P450.J.Am.Chem.Soc. (2011) 133(5):1357-66
10.Frauenfeld, J. et al. Cryo-EM structure of the ribosome-SecYE complex in the membrane environment. Nature Struct. Mol. Biol. (2011), 5:614-21
11.Marty M.T., et al. Ultra-thin layer MALDI mass spectrometry of membrane proteins in Nanodiscs. Anal. Bioanal. Chem. (2012) 402(2):721-9
12.Wang, Z. et al. Tyrosine phosphorylation of Mig6 reduces its inhibition of the epidermal growth factor receptor. ACS Chem. Biol. (2013) 8(11):2372-6.
13.Pandit A., et al. Assembly of the major light-harvesting complex II in lipid Nanodiscs. Biophys. J. (2011) 101:2507-2515
14.Bhattacharya, P. et al. Nanodisc-incorporated hemagglutinin provides protective immunity against influenza virus infection. J. Virology (2010) 361-371
15.Marty M.T. et al., Nanodisc-solubilized membrane protein library reflects the membrane proteome. Anal. Bioanal. Chem. (2013) 405(12):4009-16
16.Moers et al., Modified lipid and protein dynamics in Nanodiscs. Biochim. Biophys. Acta (2013), 1828(4):1222-9.
17.Nasr. et al., Radioligand binding to Nanodisc-reconstituted membrane transporters assessed by the scintillation proximity assay. Biochemistry (2014), 14;53(1):4-6.
18.Kobashigawa. et al., Phosphoinositide-incorporated lipid-protein Nanodiscs: A tool for studying protein-lipid interactions. Anal. Biochem. 410 (2011), 77-83












 首页
首页 Facebook
Facebook WeChat
WeChat Twiitter
Twiitter
